什么是電化學循環伏安法?
在電化學研究中,循環伏安法是一種簡單而又強大的研究方法。通過循環伏安法,可以對電極可逆性進行判斷:反應是可逆的,則曲線上下對稱,若反應不可逆,則曲線上下不對稱;判斷電極反應機理的判斷:如電極吸附現象、電化學反應過程中產物等;更重要的是,循環伏安法能夠用于實驗中的定量分析。接下來,運用實驗數據來答疑解惑。
通常我們選擇鐵氰化鉀體系(Fe(CN)63-/4-)對電化學行為中的可逆過程進行研究,它的氧化與還原峰對稱,兩峰的電流值相等,兩峰電位差理論值為0.059V。通常電極表面的處理對該理論值有很大的影響,一般選擇玻碳電極為工作電極、鉑電極為對電極、飽和甘汞電極為參比電極。選擇Al2O3拋光粉將電極表面磨光,然后在拋光機上拋成鏡面,最后分別在1:1乙醇、1:1HNO3和蒸餾水中超聲波清洗15秒。另外,溶液是否除氧,這個也是必須考慮的,我們選擇通高純N2除O2。在電解池中放入5.00×10-4mol/LK3(內含0.20mol/L KNO3,作為支持電解質。支持電解質的濃度實際上也對實驗有影響,此處暫不考慮)。插入工作電極、鉑絲輔助電極和飽和甘汞電極。設置電化學工作站中的參數,參數的設定需要不斷的嘗試,根據電化學工作站窗口顯示的圖形調節出合適的參數。
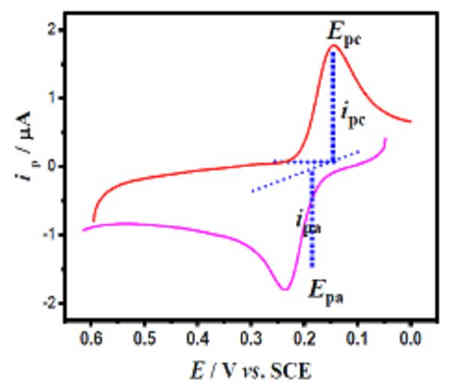
圖一:K3Fe(CN)6溶液的循環伏安曲線
圖一的i-E曲線即為循環伏安圖。從循環伏安圖中可以看出有兩個峰電流和兩個峰電位,陰極峰電流ipc,峰電位以Epc(jpc)表示;陽極峰電流ipa,峰電位以Epa表示。ipc或ipa的下標的a代表anode,c代表cathode。我們可知道,ΔEp=Epa-Epc=56/n(單位:mV)(n為反應過程中的得失電子數),ipc與ipa的比值越接近于1,則該體系的可逆程度就越高。這是判斷可逆體系的最直接的方法。
從電化學工作站的工作界面,可以得出氧化峰電位為Epa=227mV,峰電流為ipa=-1.91′10-6A;還原峰電位是Epc=170mV,峰電流是ipc=1.9′10-6A。氧化峰與還原峰電位差為57mV(直接比較橫坐標數值即可),峰電流的比值為:ipa/ipc=1.005≈1。由此可知,pH=7時,鐵氰化鉀體系(Fe(CN)63-/4-)的電化學反應是一個可逆過程。(通常都是借助該體系與其它體系進行比較,鑒別電極的優劣以及反應可逆程度)。
接下來,我們來研究掃速與峰電流及峰電位的關系。本實驗室通常選擇鐵氰化鉀作為實驗對象。不同掃描速率100、200、300、400mV/s,分別記錄從-200~+600mV掃描的循環伏安圖。記錄循環伏安曲線,觀察峰電位和峰電流,判斷電極活性。
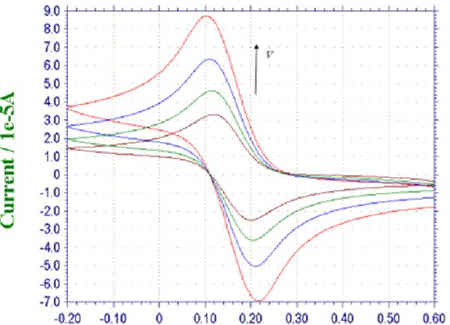
圖二:不同掃描速率下鐵氰化鉀溶液的循環伏安曲線
將不同掃描速率100、200、300、400mV/s的循環伏安曲線進行疊加,如上圖所示。由圖可知,隨著掃描速度的增加,峰電流也增加。且分別測量他們的峰數據可以得到峰電流與掃描速度的關系。根據電化學理論,對于擴散控制的電極過程,峰電流ip與掃描速度的二分之一次方呈正比關系,即ip~n1/2為一直線。對于表面吸附控制的電極反應過程,峰電流ip與掃描速度呈正比關系,即ip~n為一直線。
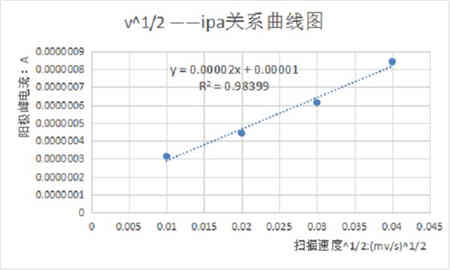
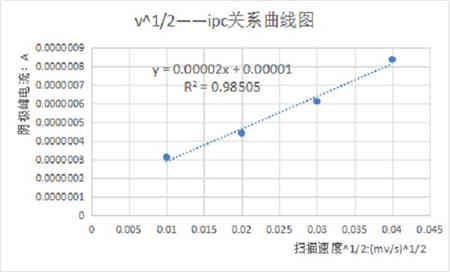
圖三:掃描速率與峰電流的關系曲線
以上詳細介紹了循環伏安法在電化學應用中的定量分析,如有不足,歡迎批評指正。最后,我針對微信留言區的問題來做解答。
一、計算擴散系數時,n是否取值?
答:物質的擴散系數表示它的擴散能力,結合物理化學中談到的菲克定律,擴散系數是沿擴散方向,在單位時間每單位濃度梯度的條件下,垂直通過單位面積所擴散某物質的質量或摩爾數。質量擴散系數D和動量擴散系數ν及熱量擴散系數α具有相同的單位(m^2/s)或(cm^2/s),擴散系數的大小主要取決于擴散物質和擴散介質的種類及其溫度和壓力。
二、測試時,攪拌溶液對CV曲線有什么影響,峰電流與峰電位怎么變化?
答:攪拌溶液,對CV曲線是有很大的影響,人為攪拌破壞了界面擴散狀態,能夠及時補充電解質,使得氧化還原電流增大。同時,溶液有波動,會影響曲線的穩定性。但是,如果電極界面有氣泡產生(比如析氫或者吸氧反應),電極界面會不斷的析出氣泡。如果不攪拌,氣泡就會吸附在電極表面,造成電極與溶液隔離,測出來的CV曲線就會不準,這個時候就可以通過攪拌來促進氣泡快速逸出。
三、極化控制與擴散控制
極化可分為濃差極化和電化學極化。
濃差極化:可逆且快速的電極反應使電極表面液層內反應離子的濃度迅速降低(或升高)--->電極表面與溶液本體之間的反應離子濃度不一樣,形成一定的濃度梯度--->產生濃差極化--->電極表面液層的離子濃度決定了電極的電位,此電位偏離了電極的平衡電位,偏離值稱為濃差過電位。 電化學極化 電極的反應速度較慢―――>當電流密度較大時,引起電極上電荷的累積―――>產生電化學極化―――>電極的電位取決于電極上所累積的電荷,此電位偏離了電極的平衡電位。但是與反應活化能有關的極化都是不可消除。
擴散控制:它是化學反應速率因反應速度過快,無法由分子完成而是由擴散來控制的現象。擴散控制是由于化學反應太快,擴散來不及供給反應以足夠的分子所致。
- 上一篇:電芯UL1642認證、充電機充電蓄電池UL2054認證詳解 2018/8/4
- 下一篇:飽和了嗎?充電樁-蓄電池充電機行業面臨優勝劣汰淘汰賽的殘酷發 2018/8/2
